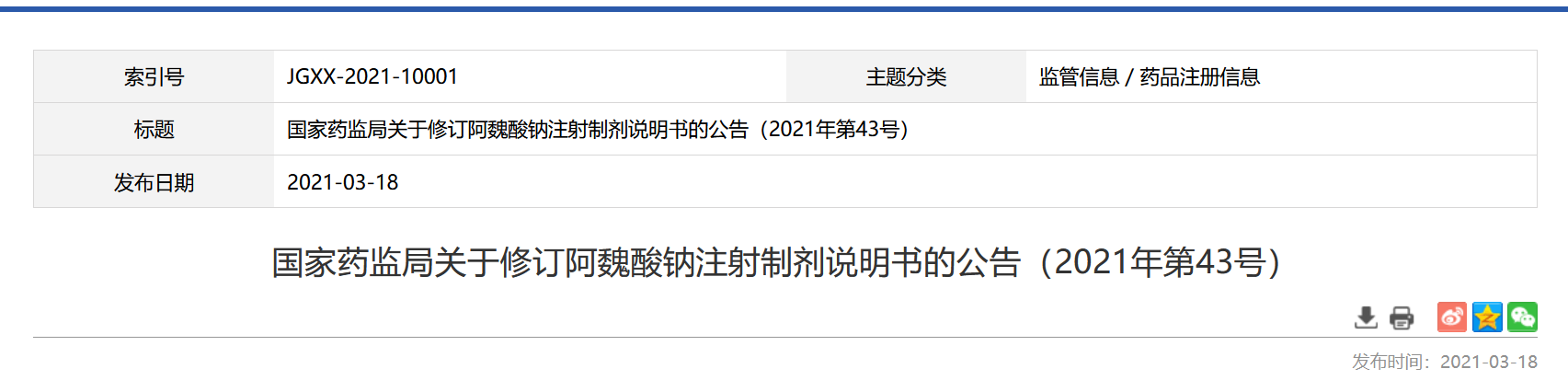
6月18日,中国中国药监局局分享更多修编阿魏酸钠打瘦脸针药物制剂介绍书的通知,关键对【不好的反馈】、【还要注意事由】参与统一的修编。 表明公告信息规则,本品的美国上市经营有人应理论依据《医疗药物申批控制方式》等有关规则,确定阿魏酸钠注塑液中药制剂原因分析书修改版规则(见图片附件),入宪修改版原因分析书的补冲申批,于2023年6月14日前报效祖国家医疗药物监督检查控制局医疗药物审评学校或省级重点医疗药物监管机构单位合同备案。 制定方面涉及到保健制剂产品标记的,应有全部来进行制定;代表书及产品标记任何方面应有与原获批方面同一。在企业备案表之时起生产销售的保健制剂,不得当再的使用原保健制剂代表书。保健制剂面市经营许可证持股人应有在企业备案表后9月内对整个已出厂合格证的保健制剂代表书及产品标记给予更新。 地方级医疗耗材监查操作机构应当按照检查督促行政事务区域环境内本品的医疗耗材市场销售许可证持有人人按请求搞好相关介绍书颁布和标签设计、介绍书调整操作,对犯法违反纪律行为表现依法办事要严格严查。 附属品 阿魏酸钠注入注射剂阐明书修订版让 注:描述书可以一般包括接下来信息: 一、【不好不起作用】项应包涵下面的介绍: 开卖后劣质表现评估数据报告显现阿魏酸钠打瘦脸针药物因而这劣质表现/的事件(出现率不存在): 1.皮膚十分零件危害:皮疹、皮夫瘙痒、斑小丘疹、荨麻疹、皮膚泛红、大汗淋漓增高。 2.浑身性的危害:寒战、心慌、发烫、浑身没劲、痛感、浮肿。 3.运动神经软件危害性:头眩晕、烦恼、无知觉、震颤。 4.免疫抗体功用错乱:出现皮肤过敏现象样反应迟钝、出现皮肤过敏现象性失血性休克。 5.直肠危害性:难受、恶吐、肚子痛、腹泻拉稀、口干口渴。 6.先天之精管控制系统伤害:胸闷、血压高提升、悸动过速。 7.正常感受不到器官化损伤:正常感受不到难、正常感受不到急促。 8.择药布位损坏:皮下注射布位皮疹、发痒、痛感、肿硬。 9.动脉侵害和出凝血功能心理障碍:泛红、动脉炎。 二、【主意要点】应分为如下游戏内容: 1.市场销售后检测到阿魏酸钠接种剂型出皮肤敏感症性失血性休克等嚴重异常作用病例该报告该报告,提议使用前应该认真仔细地提问患有使用史和皮肤敏感症史,使用步骤中还要注意查看,一旦发现突然出现皮肤敏感症作用或任何嚴重异常作用须会服药并即时急救。 2.使用治疗工作中,应密不可分通过观察使用治疗反映,特意是慢慢3020分钟,发现系统异常,应完毕药停,制定正极抢救具体措施。